新聞資訊

行業資訊
中藥和生物制品注冊改革啟幕!兩意見稿透露未來風向
來源:醫藥網發布時間:2017-11-02點擊:7277次
醫藥網10月27日訊 10月23日,CFDA先后發布《藥品注冊管理辦法(修訂稿)》和《<中華人民共和國藥品管理法>修正案(草案征求意見稿)》的征求意見稿,都是圍繞10月1日中央辦辦公廳、國務院辦公廳印發《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》提出36項重要改革措施做的修改。
其中,對臨床研究審批“寬進嚴出”,明確藥品的責任主體是藥品上市許可持有人,對藥品管理采取全鏈條和全生命周期管理,國內藥品管理及注冊逐步向國際靠攏等,都將進一步推動國內藥企往國際化方向發展。
中藥、生物制品新分類公布
哪些是未來申報熱點?
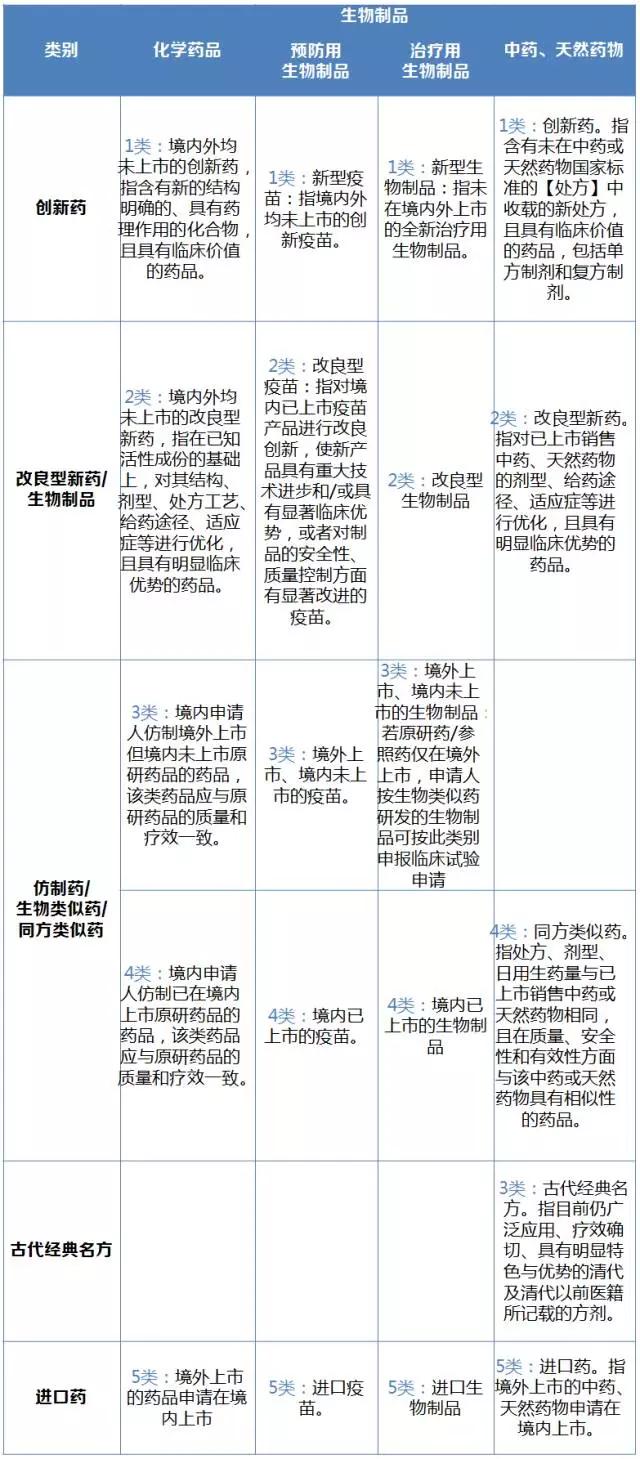
《藥品注冊管理辦法(修訂稿)》公布了最新的生物制品和中藥、天然藥物的分類,分類方法與此前公布的化學藥品分類方法基本相似,以創新藥、改良藥和仿制藥進行分類,中藥、天然藥物單獨設定了個新3類古代經典名方。生物制品分為預防用生物制品和治療用生物制品。
備受關注的國際前沿的免疫細胞療法如嵌合抗原受體T細胞(CAR-T)、自然殺傷細胞(natural killer cell,NK)和靶向活化自然殺傷細胞(taNK Cell)等,也有了申報類別——“申請人欲將細胞治療類產品按藥品進行注冊上市的,可按治療用生物制品相應類別要求進行申報。全新的基因治療和細胞治療類生物制品(例如創新機理、新載體、新靶細胞等),應當按照注冊分類1類申報。在境內外已上市制品基礎上進行改進的基因治療和細胞治療類生物制品,應當按照注冊分類2類申報”。
生物制品的進口藥分類與化學藥品的進口藥分類略有不同。化學藥品將進口藥根據原研還是仿制分為“5.1境外上市的原研藥品(包括原料藥及其制劑)申請在境內上市”和“5.2境外上市的非原研藥品(包括原料藥及其制劑)申請在境內上市”。生物制品則還是沿用創新藥、改良藥和仿制藥分類方法:預防用生物制品的新5類“進口疫苗”分為“5.1新型疫苗”“5.2改良型疫苗”“5.3境外上市、境內未上市的疫苗”和“5.4境內已上市的疫苗”四類;治療用生物制品的新5類分為“5.1新型生物制品”“5.2改良型生物制品”“5.3境外上市、境內未上市的生物制品”和“5.4境內已上市的生物制品”。
表1 新版化學藥品,生物制品,中藥、天然藥物分類
(數據來源:咸達數據V3.2)
創新藥應當具有明確的臨床價值;改良型新藥應當比原品種具有明顯的臨床優勢;仿制藥應當與原研藥品或參比制劑質量和療效一致;生物類似藥、同方類似藥應當與原研藥品或參照藥品質量和療效相當;來源于經典名方的中藥復方制劑應當在處方、生產工藝、給藥途徑、功能主治等方面與傳統應用保持一致。若以上藥品分類滿足不了對應的相關要求,將不予批準上市許可申請。
值得注意的是,在《中華人民共和國藥品管理法》修正案草案征求意見稿中,刪去“發給新藥證書”的字眼。因而,新藥證書對應的政策激勵有可能取消,取而代之的可能是試驗數據保護期。而有望獲得激勵的產品類別有創新藥、罕見病治療藥品、兒童專用藥、創新治療用生物制品以及挑戰專利成功的首仿藥。改良型新藥雖然屬于新藥,但在《藥品注冊管理辦法(修訂稿)》中并沒有獲得政策激勵。
化學藥品注冊新分類方法執行以來,1類創新藥、4類境內原研已上市仿制藥和5類進口藥是主要的申報熱點。預計預防用生物制品中的1類新型疫苗和5類進口疫苗,治療用生物制品中的1類新型生物制品、4類境內已上市的生物制品中的“4.1生物類似藥”和5類進口生物制品,中藥、天然藥物的3類古代經典名方,將是未來的申報熱點。
臨床研究審批“寬進嚴出”、與國際接軌
試驗數據管理將受重視
由于對第三章“藥物臨床試驗”內容的細化,《藥品注冊管理辦法(修訂稿)》中藥物臨床試驗出現頻次共111次,相較于2007年版的僅出現27頻次,可見新規對藥物臨床試驗的重視。
臨床研究審批進入“寬進嚴出”時代的“寬進”標志,除了已經開展的仿制藥生物等效性試驗備案制,還有就是藥物臨床試驗的啟動,從“收到臨床批件才允許啟動”改為“期限內默許啟動”,國家藥品監督管理部門依據相關法規和技術要求,對藥物臨床試驗申請進行審評審批,藥品審評機構60天內形成審評結論,未給出否定或質疑意見的,自受理之日起第61個工作日視為同意,申請人可按照提交的方案開展藥物臨床試驗。
藥物臨床試驗以往的批準模式是發給申請人臨床批件。新規下藥物臨床試驗申請視為同意的,申請人可以使用原始編號登錄相關系統,自行打印許可文件啟動藥物臨床試驗;進口藥品申請人憑打印的許可文件辦理臨床試驗用藥的進口通關。藥品審評機構對藥物臨床試驗申請不予批準的,發給申請人《審批意見通知件》,并說明理由。新規的改變將推動技術轉讓中合同內容的改變,許可文件的獲得將是“臨床批件獲得”同階段同性質的里程碑標志。
“嚴出”的標志就是2015年起已經在執行的臨床自查核查,《藥品注冊管理辦法(修訂稿)》再一次強調了臨床數據真實性的重要性——在注冊管理過程中發現申報資料或備案信息不真實或者發現涉及真實性問題申請人無法做出合理解釋的,藥品審評機構可不再繼續進行綜合評估,作出直接不予批準結論。
此外,藥品審評機構將對申請人提交的首次藥物臨床試驗方案、后續藥物臨床試驗方案和方案變更、藥物臨床試驗期間的各類報告、溝通交流中提及的科學問題等進行審查,并且可以在藥物臨床試驗過程中啟動監督檢查:若發現申請人未按要求及時報告非預期嚴重不良反應,或有證據證明試驗藥物受益風險比明顯低于已批準藥品,或發生非預期嚴重不良反應等且經評估威脅受試者安全,或存在藥物臨床試驗弄虛作假等情形之一的,藥品監督管理部門可采取暫停或終止藥物臨床試驗的措施。以上政策都顯示了CFDA對臨床研究管理越來越注重過程管理,這也是“嚴出”管理的表現。
海外臨床試驗數據的認可、試驗數據保護等政策,顯示了我國正逐步與國際藥政相接軌。享有保護待遇的“自行取得且未披露的試驗數據”更多會是臨床試驗數據。在數據保護期的激勵之下,藥品上市許可持有人或生產企業將會越來越重視對臨床試驗數據的保護與管理。
思考<<<
首仿藥競爭如何突圍而出?
中國上市藥品目錄集制度(即“橙皮書”)在建,已上市藥品信息將要公開,說明書的信息、審評結論及依據(剔除企業商業及技術秘密部分)也要公開了。
其中特別值得關注的是,進口藥申請注冊時,外文資料應當提交中文譯本,中文譯本的內容應當與外文資料一致,不一致的以中文譯本為準。這意味著原研藥進口中國成功上市后,一些基本的注冊申報資料將被公開,并且是中文版的。國內仿制藥企業都可以借鑒原研藥的相關資料,資料關未來都不會是新4類化學藥品的攔路虎。那么,能否生產與原研藥質量一致的產品,備案制下如何提高臨床試驗管理效率,以及能否挑戰專利成功,都是考驗各家搶新4類首仿的核心關鍵點。
對于新3類首仿藥,未來立項可以參考CFDA提供的《專利權到期、終止、無效尚且無仿制申請的藥品清單》。2017年10月20日,CDE發布的關于征求《首批專利權到期、終止、無效尚且無仿制申請的藥品清單》意見的通知中,公布了10個具有明確臨床價值的國內化合物專利權到期、終止、無效且尚無仿制申請的國外已上市藥品。咸達數據V3.2發現,此10個藥品僅依魯司他的原研廠家Genzyme Corporation在中國申報注冊,其余藥品都暫無國內外廠家申報,這或許和10個藥品的適應癥都比較“冷門”有關。
不考慮境外臨床試驗數據的可接受性對注冊的影響,按《接受境外臨床試驗數據的技術要求(征求意見稿)》,“在境外開展仿制藥研發,具備完整可評價臨床試驗與數據的,可用于在中國的藥品注冊申報”,這將會推動國內企業尋找海外的合作伙伴做進口仿制藥的引進工作,對應的仿制藥競爭加劇,最后難免會陷入成本競爭。海外引進產品的整體成本通常高于國內生產成本,未來可能選擇建立合資企業在國內生產以降低成本。國內仿制藥企業在立項前應對海外注冊情況做分析,并且做好要打成本戰的準備
返回

